.
Οξυγόνο
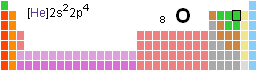
Το χημικό στοιχείο Οξυγόνο (Oxygen, O) είναι ένα αμέταλλο με ατομικό αριθμό 8 και ατομικό βάρος 15,9994 .
Άχρωμο, άοσμο , άγευστο , αέριο χημικό στοιχείο που απαντά ελεύθερο στον αέρα, αποτελεί το 20% της ατμόσφαιρας, και απαντά επίσης σε ενώσεις στο νερό, την άμμο κλπ
Χρήσεις : πολύ δραστικό στοιχείο συνδυάζεται με όλα τα άλλα χημικά στοιχεία, είναι το πιο κοινό στοιχείο στην επιφάνεια της γης, και είναι ουσιώδες για τη ζωή και για τις καύσεις
Σύμβολο O - ατομικός αριθμός 8- πυκνότητα 1,429 g/l (0°C) - σημείο τήξης - 218,4°C - σημείο βρασμού - 182,96°C
Προέλευση. Το οξυγόνο είναι το πιο διαδομένο στοιχείο στη φύση όπου το συναντούμε τόσο ελεύθερο όσο και με τη μορφή ενώσεων. Αποτελεί το 50% περίπου του στερεού φλοιού της γης, των θαλασσών και της ατμόσφαιρας. Ελεύθερο βρίσκεται κυρίως στην ατμόσφαιρα, που αποτελείται από 78% άζωτο και 21 % οξυγόνο κατ' όγκο, μαζί με μικρή ποσότητα άλλων αερίων. Σε μικρά ποσά βρίσκεται διαλυμένο στο νερό. Ενωμένο βρίσκεται στο νερό, στο στερεό φλοιό της γης - άμμος, άργιλος, γρανίτης, ασβεστόλιθος κι άλλα ορυκτά - και στους ζωικούς και φυτικούς οργανισμούς - άμυλο, κυτταρίνη, σάκχαρα, λίπη, λευκώματα κ.ά.
Ανακαλύφτηκε και μελετήθηκε απ' τους Σέελ και Πρίσλεϊ. Το όνομά του δόθηκε απ' το Λαβουαζιέ, που ερεύνησε το ρόλο του στα φαινόμενα της καύσης.
Ιδιότητες: Στις συνηθισμένες συνθήκες θερμοκρασίας και πίεσης το οξυγόνο είναι αέριο, άχρωμο, άοσμο κι άγευστο. Είναι λίγο βαρύτερο απ' τον αέρα κι ελάχιστα διαλυτό στο νερό. Υγροποιείται δύσκολα, αν υποβληθεί σε πολύ χαμηλή θερμοκρασία και πολύ ψηλή πίεση. Έχει ατομικό βάρος 16. Είναι διάτομο, δισθενές ηλεκτραρνητικό στοιχείο. Δεν καίγεται, αλλά συντελεί στην καύση άλλων ουσιών.
Το οξυγόνο είναι δραστικότατο στοιχείο. Ενώνεται με όλα σχεδόν τα στοιχεία και τα μετατρέπει σε οξείδια. Επίσης οξειδώνει πλήθος χημικών ενώσεων. Σχηματίζει, σε ορισμένες αναλογίες, με αναφλέξιμα αέρια (υδρογόνο, μεθάνιο κ.ά.) εκρηκτικά μείγματα. Ανιχνεύεται απ' το ότι διατηρεί την καύση, χωρίς το ίδιο να καίγεται.
Παρασκευές: Εργαστηριακά το οξυγόνο παρασκευάζεται:
* Από οξείδια και υπεροξείδια με θερμική διάσπαση
* Από οξείδια και υπεροξείδια με συνθέρμανση με πυκνό θειικό οξύ
* Από οξυγονούχα άλατα με θερμική διάσπαση
* Από οξυγονούχα άλατα με συνθέρμανση με πυκνό θειικό οξύ.
Βιομηχανικά παρασκευάζεται:
* Με απόσταξη του υγρού αέρα.
* Με ηλεκτρόλυση του νερού.
* Χρήσεις: Το ατμοσφαιρικό οξυγόνο χρησιμεύει:
* Για την αναπνοή του ανθρώπου και των ζώων. Τούτο εισπνέεται, για να προκαλέσει την οξείδωση των τροφών, που έχει σαν αποτέλεσμα την έκλυση της ζωικής θερμότητας. Το οξυγόνο του αέρα που εισπνέουμε μπαίνει απ' τους πνεύμονες στο αίμα κι ενώνεται με τη χρωστική του αίματος, την αιμοσφαιρίνη, προς μία ασταθή ένωση, την οξυαιμοσφαιρίνη. Η τελευταία μεταφέρεται με το αρτηριακό αίμα στους ιστούς, όπου αποδίδει το οξυγόνο, που προκαλεί την οξείδωση των τροφών, με κύρια προϊόντα διοξείδιο του άνθρακα και υδρατμούς που εκπνέονται.
* Για την καύση των διάφορων καύσιμων υλών, όπως του γαιάνθρακα, του πετρελαίου, του υγραερίου κ.ά.
* Για τον αερισμό του πόσιμου νερού.
* Για τη σήψη των ζωικών και φυτικών υπολειμμάτων.
Το καθαρό οξυγόνο, που κυκλοφορεί στο εμπόριο μέσα σε χαλύβδινες φιάλες υπό πίεση, χρησιμοποιείται:
* Για την επίτευξη μεγάλων θερμοκρασιών, με καύση σε ειδικές συσκευές μείγματος οξυγόνου με υδρογόνο ή ακετυλένιο. Η οξυυδρική φλόγα έχει θερμοκρασία περίπου 1000° C και η οξυακετυλενική θερμοκρασία περίπου 3000° C. Οι ψηλές αυτές θερμοκρασίες βρίσκουν εφαρμογή στη συγκόλληση, κοπή και τήξη των μετάλλων.
* Για την τεχνητή αναπνοή, σε περιπτώσεις πνευμονίας, δηλητηριάσεων από μονοξείδιο του άνθρακα, λιποθυμιών, πνιγμού κ.ά.
* Στις αναπνευστικές συσκευές των αεροπόρων, δυτών, πυροσβεστών, ορειβατών κ.ά.
* Ως αναισθητικό σε αναλογία περίπου 20% με υποξείδιο του αζώτου.
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
Φυσική
Χημεία
Retrieved from "http://el.wikipedia.org/"
All text is available under the terms of the GNU Free Documentation License



