.
Νάτριο
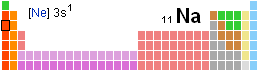
Το χημικό στοιχείο Νάτριο [σύμβολο Na (λατινικά: Natrium)] είναι ένα μαλακό δραστικό μέταλλο απ' την ομάδα των αλκαλίων στον Περιοδικό πίνακα με ατομικό αριθμό 11 και ατομικό βάρος 22,98977 . Έχει θερμοκρασία τήξης 97,8 C° και θερμοκρασία βρασμού 882,9 C°.
Το νάτριο είναι πολύ διαδομένο στη φύση με τη μορφή χημικών ενώσεων, όπως το χλωριούχο νάτριο, (αλάτι), που βρίσκεται σε πολύ μεγάλες ποσότητες στο θαλασσινό νερό, το νιτρικό νάτριο ή νίτρο της Χιλής, που είναι κρυσταλλικό και βρίσκεται μέσα στο έδαφος. Στη φύση απαντά μόνο σε ενώσεις και είναι πολύ ενεργό χημικά.
Έχει ατομικό αριθμό 11 και ατομικό βάρος 23 και ειδικό βάρος 0,968. Είναι μαλακό, στερεό, ελατό, ασημόλευκο αλκαλικό μεταλλικό χημικό στοιχείο με υφή σαν του κεριού. Οξειδώνεται όμως γρήγορα στον αέρα. Για να μην οξειδώνεται φυλάγεται μέσα σε παραφινέλαιο ή πετρέλαιο.

Νάτριο σε παραφινέλαιο (*)
Ενώνεται πάρα πολύ εύκολα με τα περισσότερα αμέταλλα και πιο πολύ με το υδρογόνο, τα αλογόνα και το θείο. Διασπά το νερό εν ψυχρώ και δίνει υδρογόνο και καυστικό νάτριο.

Οι ενώσεις του Νάτρίου χρωματίζουν τη φλόγα (*)
Παρασκευάζεται με ηλεκτρόλυση καυστικού νατρίου ή χλωριούχου νατρίου ή με αναγωγή του ανθρακικού νατρίου με άνθρακα.
Το νάτριο χρησιμοποιείται σαν αναγωγικό μέσο κι επιτρέπει την παρασκευή του πυριτίου και του βόριου. Έχει πολλές χρήσεις στην οργανική χημεία. Απ' τις πολυάριθμες ενώσεις του οι κυριότερες είναι οι εξής: Το αζίδιο και το αμίδιο του νατρίου, το ανθρακικό και το δισσανθρακικό νάτριο (σόδα), το υπερβορικό νάτριο, το θειϊκό νάτριο (άλας του Γκλάουμπερ), το θειούχο νάτριο, το νιτρικό νάτριο, το όξινο θειώδες νάτριο, το υδροξείδιο του νατρίου, το ιωδιούχο νάτριο και το χλωριούχο νάτριο (μαγειρικό αλάτι).
* Το Nάτριο ανακαλύφθηκε το 1807
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
Φυσική
Χημεία
Retrieved from "http://el.wikipedia.org/"
All text is available under the terms of the GNU Free Documentation License



